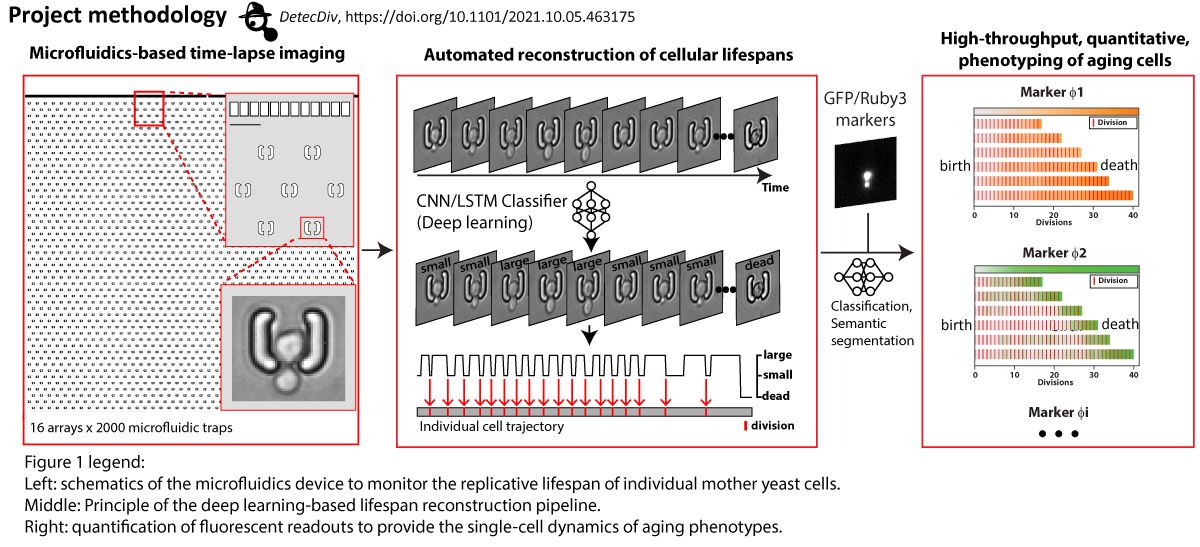
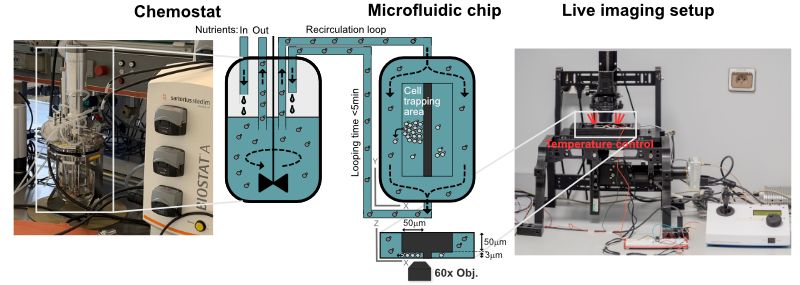
Dans des conditions spécifiques de croissance en chémostat, les populations de cellules de levure se synchronisent spontanément pour subir des oscillations métaboliques soutenues, qui semblent être étroitement couplées à la croissance et à la division cellulaire. L'ensemble de ce comportement oscillatoire est appelé le cycle métabolique de la levure (YMC). De manière intrigante, notre laboratoire et d'autres ont récemment montré que les oscillations métaboliques persistent en l'absence de division cellulaire et semblent même être importantes pour déterminer l'entrée et la sortie du cycle cellulaire. De plus, nous avons démontré que la signalisation redox est impliquée dans l'émergence d'un comportement oscillatoire métabolique collectif stable et dans le couplage de l'état métabolique oscillatoire à la division cellulaire dans le contexte du YMC. Des études récentes révèlent l'existence d'oscillations métaboliques, de signalisation redox et d'activité de la protéine kinase A au niveau de la cellule unique. En accord avec le CMJ, ces oscillations peuvent être couplées à la division cellulaire et semblent être importantes pour réguler l'entrée et la sortie du cycle cellulaire, mais elles peuvent aussi persister indépendamment de la division cellulaire. Cependant, il n'est pas clair si les cycles métaboliques observés au niveau de la cellule unique correspondent à ceux observés dans les populations synchronisées par le YMC. La base mécaniste des cycles métaboliques dans les deux systèmes est totalement inconnue et les relations causales exactes, l'interférence
et l'interaction entre les cycles métaboliques et la division cellulaire restent insaisissables. Dans ce projet de thèse, nous développerons une nouvelle méthodologie qui fusionne les mesures dynamiques à l'échelle de la population avec le suivi de cellules uniques par microfluidique. En combinant notre expertise dans la génétique de la levure, les nouveaux capteurs redox codés génétiquement, l'imagerie quantitative de cellules vivantes, la microfluidique et les cultures en chemostat, nous éluciderons l'hétérogénéité de la population en termes de cycles métaboliques et de division cellulaire avec une résolution spatiale et temporelle jusqu'ici impossible à atteindre. En outre, nous aborderons le rôle de la signalisation redox et de l'activité de la protéine kinase A dans le couplage de la division cellulaire avec le métabolisme oscillatoire. En combinant nos approches avec des analyses computationnelles, nous ferons des pas importants vers le déchiffrage des principes fondamentaux qui gouvernent l'émergence des oscillations métaboliques, l'élucidation de leurs avantages potentiels en termes de fitness dans des environnements fluctuants et la compréhension de leur pertinence pour la division cellulaire.