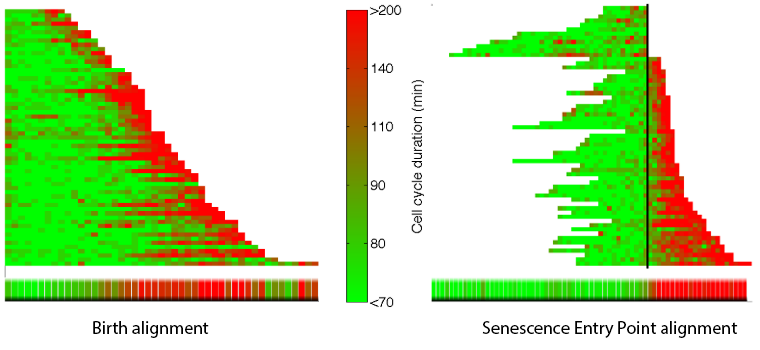
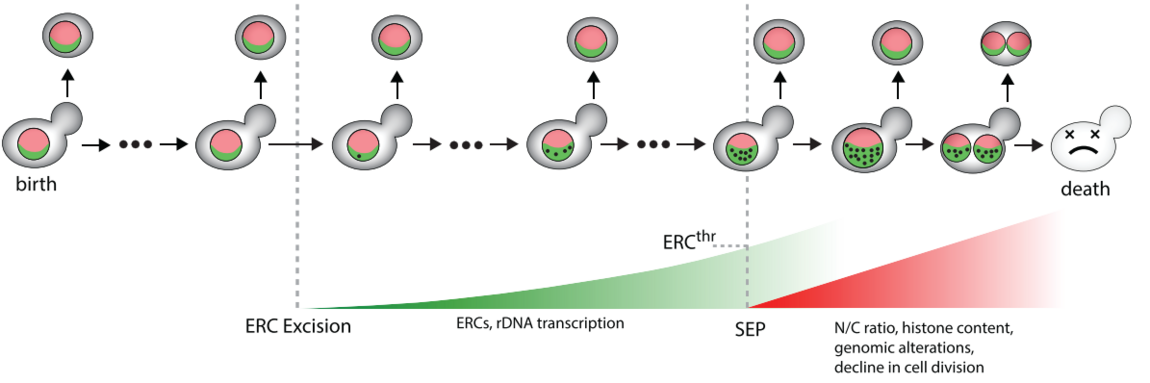
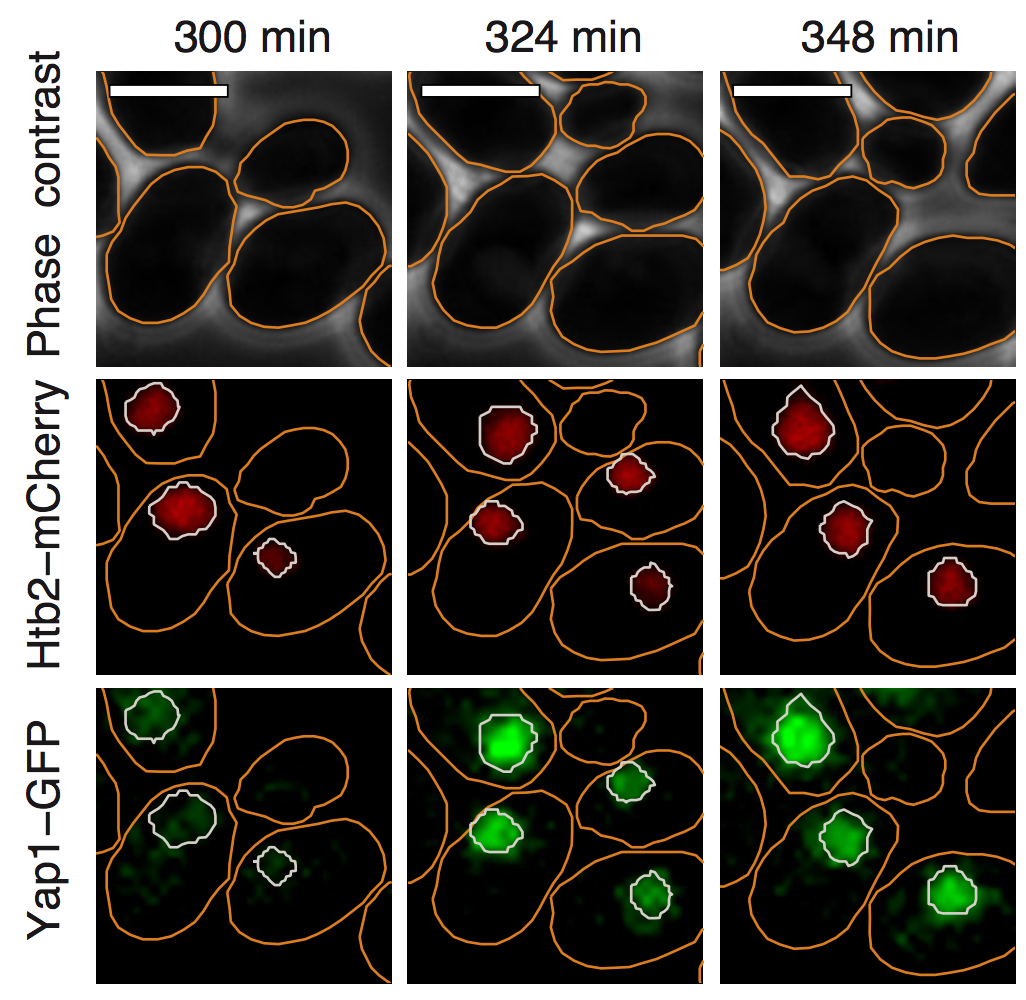
Les organismes unicellulaires ont développé divers mécanismes de défense pour tempérer les variations des paramètres physiologiques internes et pour contrer les changements imporévisibles du milieu. La réponse au stress oxydant (e.g. peroxyde d'hydrogène) est un système de régulation fondamental hautement conservé qui permet à la cellule d'ajuster précisément son équilibre redox essentiel pour un bon fonctionnement physiologique. Toutefois, bien que les acteurs moléculaires impliqués dans cette réponse soient bien identifiés au niveau biochimique, la manière dont ces composants se combinent en un système homéostatique fonctionnel n'est toujours pas élucidée.
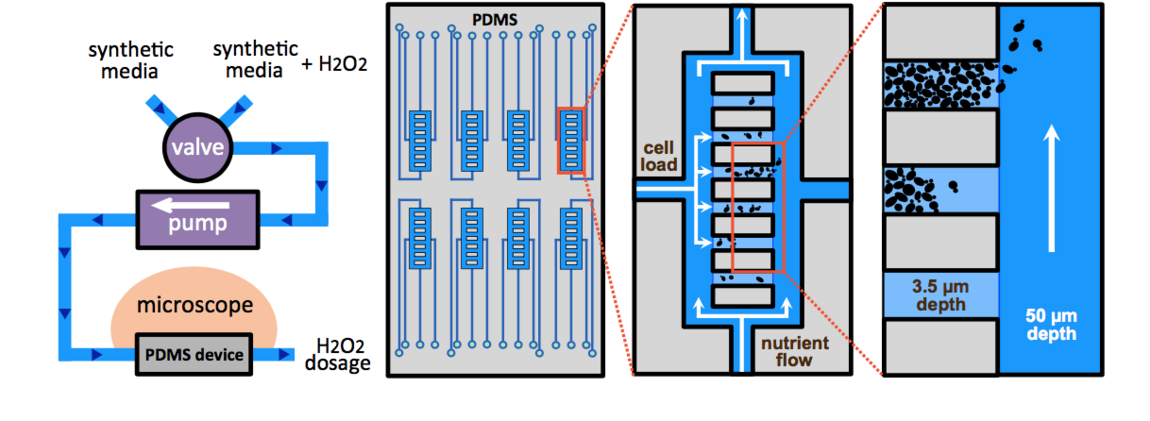
Dans ce contexte, nous avons développé une plate-forme microlfuidique pour suivre la réponse physiologique de cellules individuelles a divers motifs temporels de stress (i.e. en escalier, augmentation continue, etc.) et mis en évidence les propriétés fonctionnelles du système d'homéostasie redox. Nous avons montré que le taux d'exposition au stress en fonction du temps est un partamètre essentiel de la survie des cellules : toutes les cellules meurent lorsqu'elles sont exposées directement à une dose donnée de peroxyde d'hydrogène, mais elles peuvent survivre à des doses 10 fois supérieures si on les expose progressivement au même stress. Cette observation a révélé que l'adaptation au stress est limitée par le temps de réponse de la machinerie homéostatique ainsi que la capacité d'habituation au stress des cellules. Nous avons démontré que l'activité des peroxyrédoxines, enzymes clés dans la détoxication de H2O2, est au coeur de cette capacité d'habituation de même de que l'acquisition de la tolérance, connue de longue date.
Sachant que certains métabolites (e.g. NADPH) sont impliqués à la fois dans les processus anaboliques et le contrôle de l'équilibre redox, nous nous attachons maintenant à la mise en évidence des mécanismes de réallocation de leurs ressources de la croissance cellulaire vers la détoxication de H2O2 lorsque les cellules font face au stress oxydant.